Über Synapsen finden Informationsübertragungen
zwischen Zellen statt
(Nervenzellen-Nervenzellen, Nervenzellen-Muskelzellen, Sinneszellen-Nervenzellen).
Motorische Endplatte
Die motorische Endplatte (Synapse zwischen Nerven- und Muskelzelle) ist
die grösste Synapse bei Wirbeltieren. Wenn ein AP eine Synapse erreicht,
finden folgende Vorgänge statt:
- Erregung der präsynaptischen Nervenendigung;
- Erhöhung der Ca2+-Permeabilität und Ca2+-Einwärtsstrom;
- Freisetzung einer chemischen Substanz in der präsynaptischen
Nervenendigung (=Transmitter, bei motorischer Endplatte: Acetylcholin);
- Synaptische Verzögerung, die durch den Ca2+-Einwärtsstrom
und die Bläschenfreigabe, nicht aber durch die Diffusion zustandekommt;
- Bindung des Transmitters an den Rezeptor der postsynaptischen
Membran (ca. 10'000 Rezeptoren pro Mikroquadratmeter);
- Permeabilitätsänderung der postsynaptischen Membran;
- Entstehung eines EPSP (erregendes postsynaptisches Potential);
- Entstehung eines AP in der umliegenden erregbaren Membran.
Rezeptor: Das Wort Rezeptor wird für zwei verschiedene Strukturen verwendet:
- Zelle für Sinnesorgane
- Proteine, die spezifisch einen Transmitter oder ein Hormon binden können
Erregendes postsynaptisches Potential (EPSP)
Ein EPSP weist folgende Eigenschaften auf, die es deutlich von einem AP unterscheiden (vgl. Generatorpotential):
- kein Alles- oder Nichts-Gesetz (abhängig von der Transmitter-Konzentration)
- räumliche und zeitliche Summation
- Umkehrpotential = -15 mV
- entsteht durch Erhöhung der Na+ - und Ka+ - Permeabilität
- passive Fortleitung (ohne AP)
Unter Umkehrpotential versteht man dasjenige Potential, bei dem die Summe aller Ionenströme gleich null ist (I-Total = I-K+ I-Na+ I-Cl = 0), das EPSP verschwindet. Das Umkehrpotential ist auch das Gleichgewichtspotential aufgrund unspezifischer Erhöhung der Membranleitfähigkeit. Die Grösse und das Vorzeichen des Umkehrpotentials hängt von der jeweiligen Permeabilität ab.
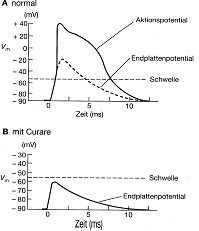
Genaue Messungen der postysnaptischen Potentiale ergaben, dass selbst bei Abwesenheit einer Erregung sehr kleine Depolarisationen auftreten (Miniatur-Endplattenpotentiale), deren Amplitude ungefähr ½ mV beträgt. Diese Miniatur–EPSPs sind der Effekt von spontan freigegebenen Bläschen. Pro AP werden ungefähr 300 Bläschen freigegeben, wobei sich in einem Bläschen zwischen 1'000 und 10'000 Moleküle (Transmitter) befinden. Durch ein Rezeptorkanal gehen pro Millisekunde etwa 10'000 Ionen.
Erregende Synapsen
Erregende Synapsen befinden sich hauptsächlich im ZNS. Sie sind änlich aufgebaut wie motorische Endplatten. Die Unterschiede sind:
- erregende Synapsen sind kleiner und setzen nur 1 Bläschen pro AP frei
- verschiedene Transmitter
- Umkehrpotential –15 bis 0 mV
Während eines EPSP sind wie bei der motorischen Endplatte die Permeabilitäten für Na+ und K+ erhöht.
Hemmende Synapsen
Hemmende Synapsen, die nur im ZNS vorkommen, sind ähnlich aufgebaut wie erregende Synapsen. Die synaptischen Bläschen können aber oval sein (nicht so bei den erregenden Synapsen). An der postsynaptischen Membran tritt eine Hyperpolarisation auf ( IPSP = inhibitorisches postsynaptisches Potential ). Während eines IPSP wird die Permeabilität für Cl - erhöht. Das Umkehrpotential eines IPSP beträgt – 80mV. Die Hemmungswirkung dieser Synapse tritt auf der postsynaptischen Membran auf und man bezeichnet diese Hemmung deswegen als postsynaptisch . Die häufigsten Transmitter bei hemmenden Synapsen sind Glycin und GABA. Die Oeffnung von K - und Cl - -Kanälen setzt den Membranwiderstand herab indem sie erregende Depolarisation „kurzschliesst„ und damit das Membranpotential auf seinem Ruhewert stabilisiert.
Präsynaptische Hemmung
Der Mechanismus der präsynaptischen Hemmung beruht auf der Interaktion zwischen zwei Synapsen. Bei Erregung der Synapse 2 durch ein AP wird der Ca + -Einwärtsstrom in Synapse 1 reduziert (Permeabilitätsänderung). Dadurch wird die Wahrscheinlichkeit, dass ein AP in der Endigung 1 ein Bläschen-Transmitter freisetzt verkleinert. Da diese Regulierung der synaptischen Uebertragung in der präsynaptischen Endigung stattfindet, wird sie als präsynaptisch bezeichnet. (Dauer des EPSP II: 100-300 ms).
Elektrische Synapsen
Dendriten oder Zellkörper treten in engen Kontakt (gap-junctions), so dass eine Potential-änderung von der einen auf die andere Zelle übertragen werden kann. Gegenüber chemischen Synapsen tritt bei der elektrischen Synapse keine synaptische Verzögerung auf und die Reizwirkung ist in beide Richtungen möglich .
Transmitter
Kriterien für Neurotransmitter sind:
- Synthese im Neuron
- präsynaptisch freigesetzt, postsynaptische Wirkung
- exergen (von aussen) verabreicht tritt die Wirkung ein
- Abbaumechanismen für Transmitter (Acetylcholinesterasen)
Zwei Gruppen werden unterschieden:
- niedermolekulare: nur wenige, welche im Endstück der Synapse entstehen
- hochmolekulare: werden im Perikaryon gebildet und über axoplasmatischen Fluss transportiert
Niedermolekulare: Die bekanntesten Transmittoren nebst Ach:
Acetylcholin: Motoneuron › Muskel, Parasympathikus
GABA: hemmend
Glycin: hemmend
Glutamat: erregend
Katecholamine Adrenalin, Noradrenalin, Dopamin
Hochmolekulare : Aendern die Wirkung der kleinen Transmittoren:
Ihre Funktion ist modulierend . Wir unterscheiden:
Eucephaline: binden sich an Morphinrezeptoren (Schmerzlinderung)
Substanz P: Schmerzübertragung
Agonist: Substanz mit gleicher Wirkung wie Transmitter
Antagonist: Substanz, die sich ebenfalls an Rezeptoren bindet, aber keine Wirkung auslösen. Es gibt kompetitive und nicht kompetitive Antagonisten. Antagonisten behindern die Wirkung der betreffenden Ueberträgerstoffe (bei reversibler Bindung kompetitiv, bei irreversibler Bindung nicht-kompetitiv).
Synaptische Rezeptoren
Ionotrope Rezeptoren: 1 Membranprotein hat Rezeptorfunktion und Kanalfunktion. Es ist ligandengesteuert. Die Wirkung ist rasch. Dazu gehören: motorische Endplatte, hemmende Synapse mit Glycin und GABA. Es braucht meist mehr als nur ein Transmitter-Molekül für die Oeffnung eines Kanals.
Metabotrope Rezeptoren: aktivieren G-Proteine, die second messenger freisetzen; diese aktivieren Ionenkanäle.
Informationsverarbeitung durch eine Nervenzelle
Synapsen gibt es zwischen folgenden Strukturen:
- Axon-Dendrit
- Axon-Soma
- Axon – Axon (präsynaptische Hemmung)
In den Dendriten und im Soma von Nervenzellen werden meistens keine AP's generiert. Der AP generierende Mechanismus liegt beim Ursprung des Axons ( initiales Segment ). Die Frequenz der beim initialen Segment generierten AP's hängt von der Depolarisation ab. Je stärker die Depolarisation desto höher ist die Frequenz der AP, die über das Axon fortgeleitet werden. Das initiale Segment wird durch den Nettoeffekt vor allem der IPSP und der EPSP's, die auf der Nervenzelle entstehen, depolarisiert. Die postsynaptischen Potentiale (PSP) breiten sich vor allem passiv über Dendriten und Soma aus und tragen auf diese Weise zur Polarisation des initialen Segmentes bei.
Als Modellvorstellung für die passive Fortleitung wird die Kabelgleichung verwendet. Es wird dabei angenommen, dass Dendriten Kabel mit einem Membranwiderstand Rm, einer Kapazität Cm, und einem Leitungswiderstand Ri darstellen. Die Distanz, über die sich ein PSP ausbreitet, kann durch die Längenkonstante ausgedrückt werden. Die Längenkonstante bedeutet, dass die Spannung über eine Distanz von L abfällt. Es folgt daraus, dass Synapsen weit aussen an den Dendriten einen kleineren, Synapsen die soma-nahe gelegen sind, hingegen einen grossen Einfluss auf das initiale Segment haben. Der Einfluss von Synapsen auf das initiale Segment wird somit durch die Geometrie einer Nervenzelle bestimmt .
Bei einem grossen Membranwiderstand geht wenig Strom verloren; L ist gross
Bei einem grossen Innenwiderstand geht viel Strom nach aussen verloren: L ist klein
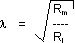
wobei l die Längenkonstante, R m der Membranwiderstand (600 Ohm cm 2 beim Motoneuron) und C m die Membrankapazität (5µF/cm 2 beim Motoneuron) sind.
Ergänzung "Synaptische Rezeptoren"
Die Bindung des Ueberträgerstoffes an den postsynaptischen Rezeptor führt bei direkt liganden-gekoppelten Kanälen zu kurzen Oeffnungen des Ionenkanals des Rezeptormoleküls.
Bei indirekt ligandengekoppelten Kanälen erzielt die Bindung von Ueberträgerstoff an den Rezeptor die Aktivierung eines G-Proteins in der inneren Schicht der Membran. Das G-Protein bindet entweder an einem Kanalmolekül, das sich öffnet oder das G-Protein wirkt über Enzym-ketten und second messenger auf Ionenkanalmoleküle. Neben diesen ionotropen Wirkungen können über second messenger auch intrazelluläre Funktionen metabotrop gesteuert werden. |
